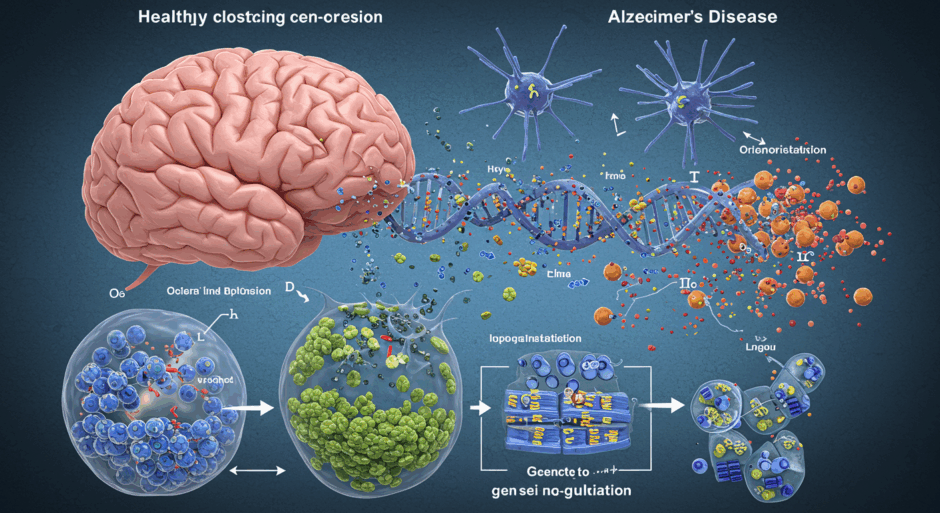
MIT研究者が2025年9月4日のCell誌に発表した研究で、アルツハイマー病の新たなメカニズムが明らかになった。研究チームは111人のドナーから得た384の死後脳サンプルを分析し、6つの脳領域にわたる350万個の細胞の遺伝子発現と遺伝子制御を調査した。研究はManolis Kellis教授とLi-Huei Tsai教授が主導し、Zunpeng LiuとShanshan Zhangが共同筆頭著者を務めた。分析対象は57の健常脳サンプル、33の初期段階病理サンプル、21の後期段階サンプルで構成された。研究結果によると、アルツハイマー病の進行は2つの主要なエピゲノム傾向で特徴づけられる。第一に脆弱な脳細胞が核コンパートメントの破綻に苦しみ、第二に感受性の高い細胞がエピゲノム情報を喪失する。研究者は100万以上の遺伝子制御領域を注釈付けし、7つの脳細胞クラスと67の細胞サブタイプを分析した。特に嗅内皮質と海馬の細胞で情報低下が顕著であった。APOE4遺伝子変異体を持つ患者では、ミクログリア細胞が初期に情報増加を示した後、急激に低下することが判明した。
From:  Alzheimer’s erodes brain cells’ control of gene expression, undermining function, cognition
Alzheimer’s erodes brain cells’ control of gene expression, undermining function, cognition
【編集部解説】
今回のMIT研究が画期的な理由は、従来のアルツハイマー病研究の常識を根本から覆したことにあります。これまで多くの研究者や製薬会社は、アミロイドプラークやタウタングルといった「症状の塊」を取り除くことに集中してきました。しかし、この新しい研究は「なぜ脳細胞がそもそも病的な状態に陥るのか」という根本原因に迫っています。
エピゲノム制御の重要性
エピゲノムとは、DNAの配列を変えることなく遺伝子の発現をオン・オフする仕組みです。この研究で明らかになったのは、アルツハイマー病において脳細胞が「自分が何者であるか」を忘れていく過程です。通常、脳の各細胞は厳格な「コンパートメント」を維持し、必要な遺伝子だけを発現させています。しかし病気が進行すると、この秩序が崩れ、本来発現してはいけない病気関連遺伝子が活性化されてしまいます。
規模と技術的革新性
この研究の技術的な凄さは、350万個という膨大な細胞を単一細胞レベルで解析し、111人のドナーから得た6つの脳領域を網羅的に調査した点です。従来の研究では組織全体を「平均化」して解析することが多く、個々の細胞の違いや変化を詳細に捉えることは困難でした。今回の研究では、67種類もの細胞サブタイプごとに、病気の進行過程を詳細にマッピングできたのです。
APOE4の新たな理解
特に注目すべきは、アルツハイマー病の最大のリスク因子であるAPOE4遺伝子について、新たなメカニズムが判明した点です。ミクログリア細胞は当初、病気と戦うためにエピゲノム情報を増加させますが、APOE4保有者では急激に「燃え尽き症候群」のような状態に陥ることが明らかになりました。これは、従来の「APOE4が悪い」という単純な理解を超えて、時系列での動的変化を捉えた画期的な発見です。
将来への影響と治療への道筋
この研究が示す未来は、個人の遺伝的背景やエピゲノム状態に基づいたパーソナライズド医療の可能性です。現在承認されているアルツハイマー病治療薬の多くは症状の進行を遅らせる程度の効果しかありませんが、エピゲノム制御を標的とした治療法は、病気の根本原因にアプローチできる可能性があります。
課題とリスク
一方で、エピゲノム制御は細胞の基本的な機能に関わるため、治療における副作用のリスクも懸念されます。また、この研究は死後脳組織の解析に基づいているため、生きている患者での動的変化を捉えることや、治療効果をリアルタイムで評価することには課題があります。
この研究は、アルツハイマー病を「プラークとタングルの病気」から「エピゲノム制御の病気」へと理解の転換を促す重要な一歩となるでしょう。将来的には、血液検査などでエピゲノム状態を評価し、発症前から予防的介入を行う時代が到来するかもしれません。
【用語解説】
エピゲノム
DNAの配列を変えることなく、遺伝子の発現をオン・オフする制御システム。細胞が「自分が何者であるか」を決める分子的な仕組みである。
トランスクリプトーム
細胞内でどの遺伝子がRNAに転写されているかを示すデータセット。遺伝子発現の全体像を把握するために使用される。
APOE4遺伝子
アルツハイマー病の最大の遺伝的リスク因子。この変異体を持つ人は病気の発症リスクが高くなる。
ミクログリア
脳内の免疫細胞。病原体や損傷した神経細胞を除去し、脳の健康を維持する役割を持つ。
オリゴデンドロサイト
神経線維を絶縁するミエリンを産生する細胞。神経伝達の効率を高める重要な役割を果たす。
クロマチンガーディアン
細胞のエピゲノムプログラムを維持・制御する遺伝子群。研究者が名付けた通称で、遺伝子発現の秩序を守る「守護者」的存在である。
単一細胞RNAシーケンシング
個々の細胞レベルで遺伝子発現を測定する最新技術。従来の組織全体を平均化した解析とは異なり、細胞ごとの詳細な違いを捉えることができる。
ATACseq
染色体のどの領域が遺伝子発現にアクセス可能かを測定する解析手法。エピゲノム状態を評価するために使用される。
【参考リンク】
ケリス研究室(外部)
MITの計算生物学グループを率いるManolis Kellis教授の研究室。ゲノミクス、エピゲノミクス、疾患メカニズムの解明に取り組む。
蔡研究室(外部)
Li-Huei Tsai教授が率いるMITの神経科学研究室。アルツハイマー病の分子メカニズム解明と40Hzガンマ波刺激による治療法開発で知られる。
ピコワー学習記憶研究所(外部)
MITの学習と記憶に関する研究機関。Li-Huei Tsai教授が所長を務め、神経変性疾患の研究を行っている。
Cell誌(外部)
今回の研究が発表された科学雑誌Cellの該当論文ページ。アルツハイマー病のエピゲノム制御に関する詳細な研究結果が掲載されている。
【参考記事】
Single-cell multiregion epigenomic rewiring in Alzheimer’s disease progression and cognitive resilience(外部)
Cell誌に掲載された原著論文。67種類の細胞サブタイプと100万以上の遺伝子制御領域を分析し、エピゲノム安定性の動態を解明した研究である。
Epigenomic erosion linked to cognitive decline in Alzheimer’s patients(外部)
研究結果を詳細に解説した医学系メディアの記事。エピゲノム制御の破綻と認知機能低下の関連性について、数値データを交えて説明している。
Single-Cell Atlas Links Epigenomic Decline to Cognitive Loss(外部)
技術系メディアによる研究解説記事。単一細胞レベルでの解析技術とその革新性について技術的観点から詳述している。
【編集部後記】
この研究を読んで、私たちの脳細胞が遺伝子発現の「コントロール」を巡って、毎日静かな戦いを繰り広げていることに驚きませんか?アルツハイマー病は単に「忘れる病気」ではなく、細胞レベルでの「アイデンティティの喪失」なのかもしれません。
皆さんご自身やご家族の健康を考える際、生活習慣が遺伝子の働き方に与える影響について、どんなことを意識されていますか?今回の発見が、将来的にどのような予防法や治療法につながっていくと思われますか?エピゲノム制御という新しい視点から、脳の健康について一緒に考えてみませんか。